Un equipo dirigido por Penn ha revelado cómo la hidralazina, uno de los medicamentos para la presión arterial más antiguos del mundo y un tratamiento fundamental para la preeclampsia, funciona a nivel molecular. Al hacerlo, hicieron un descubrimiento sorprendente: —también puede detener el crecimiento de tumores cerebrales agresivos.
Conclusiones clave
- Un medicamento común para la preeclampsia, la hidralazina, actúa sobre una enzima llamada 2-aminoetanotiol dioxigenasa (ADO)—, un interruptor molecular para el oxígeno que indica a los vasos sanguíneos cuándo deben apretarse.
- La hidralazina también puede resultar útil en el tratamiento de una de las formas más agresivas de cáncer cerebral, el glioblastoma.
- Los hallazgos resaltan cómo los tratamientos establecidos desde hace mucho tiempo pueden revelar un nuevo potencial terapéutico y podrían ayudar en el diseño de medicamentos más seguros y efectivos tanto para la salud materna como para el cáncer cerebral.
Durante los últimos 70 años, la hidralazina ha sido una herramienta indispensable en medicina—una defensa de primera línea contra la presión arterial alta potencialmente mortal, especialmente durante el embarazo. Pero a pesar de su papel esencial, ha persistido un misterio fundamental: nadie conoce su “mecanismo de acción”—esencialmente cómo funciona a nivel molecular, lo que permite una eficacia y seguridad demostradas, y lo que puede tratar.
“La hidralazina es uno de los primeros vasodilatadores jamás desarrollados y sigue siendo un tratamiento de primera línea para la preeclampsia—, un trastorno hipertensivo que representa entre el 5% y el 15% de las muertes maternas en todo el mundo,” dice Kyosuke Shishikura, médico científico de la Universidad de Pensilvania. “Proviene de una era ‘pre-objetivo’ de descubrimiento de fármacos, cuando los investigadores se basaron primero en lo que veían en los pacientes y sólo más tarde intentaron explicar la biología detrás de ello”.
Ahora Shishikura, su asesor postdoctoral en Penn Megan Matthews, y los colaboradores han resuelto este viejo enigma.
En un artículo publicado en Avances científicos, El equipo descubrió el método de acción de la hidralazina y, al hacerlo, reveló un vínculo biológico inesperado entre los trastornos hipertensivos y el cáncer cerebral. Los hallazgos resaltan cómo los tratamientos establecidos desde hace mucho tiempo pueden revelar un nuevo potencial terapéutico y podrían ayudar en el diseño de medicamentos más seguros y efectivos tanto para la salud materna como para el cáncer cerebral.
“La preeclampsia ha afectado a generaciones de mujeres de mi propia familia y continúa afectando desproporcionadamente a las madres negras en los Estados Unidos”, dice Matthews. “Comprender cómo funciona la hidralazina a nivel molecular ofrece un camino hacia tratamientos más seguros y selectivos para la hipertensión relacionada con el embarazo —mejorando potencialmente los resultados para las pacientes con mayor riesgo”.
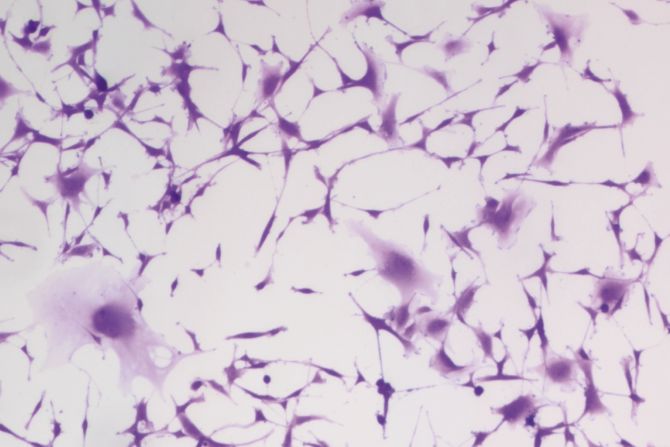
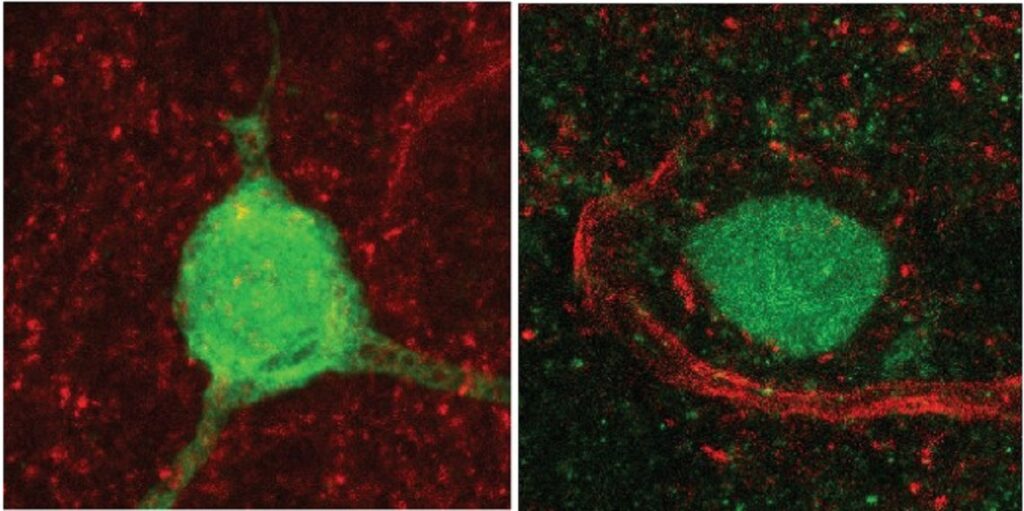
Investigadores del laboratorio Megan Matthews en Penn trataron células tumorales cerebrales de glioblastoma humano con hidralazina, uno de los medicamentos para la presión arterial más antiguos conocidos y un tratamiento de primera línea para la preeclampsia, durante tres días. Al tercer día (imagen), más células se agrandan y aplanan —un sello distintivo de la senescencia, la no división “modo de sueño” que detiene el crecimiento del tumor.
(Imagen: Cortesía de Kyosuke Shishikura)
La hidralazina bloquea una enzima sensora de oxígeno
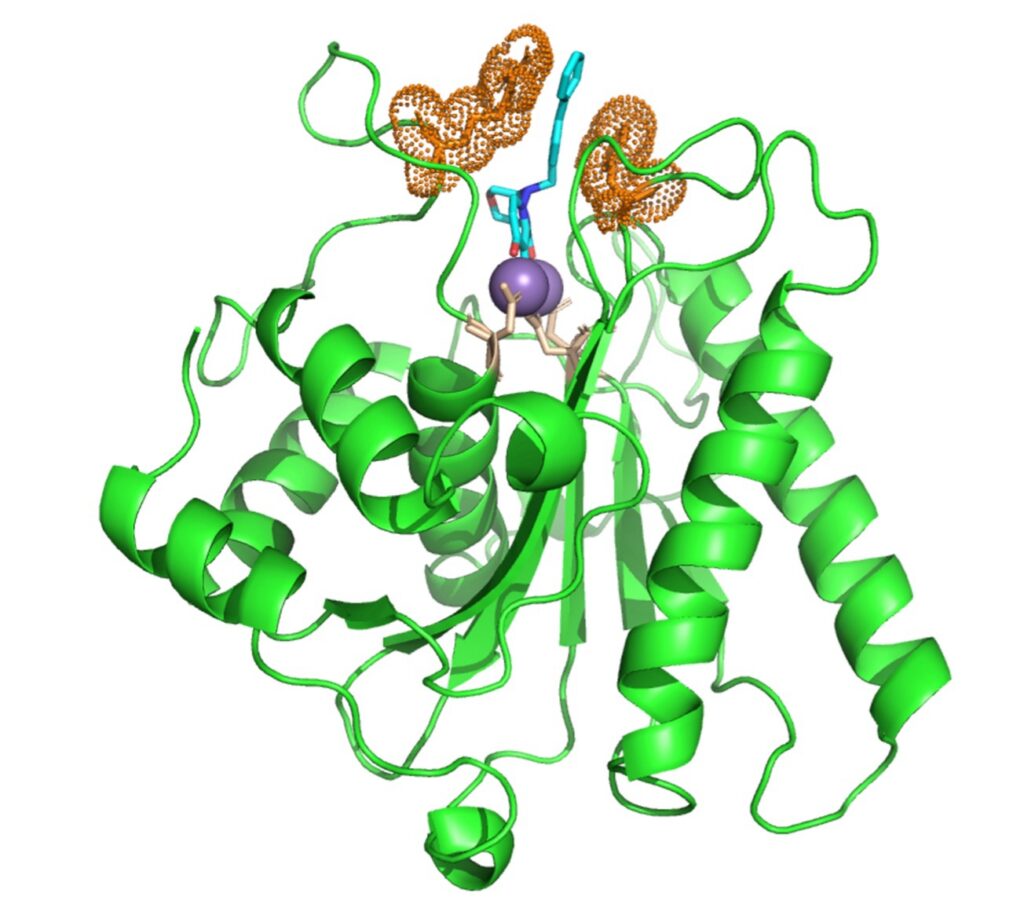
El equipo descubrió que la hidralazina bloquea una enzima sensora de oxígeno llamada 2-aminoetanotiol dioxigenasa (ADO)—, un interruptor molecular que indica a los vasos sanguíneos cuándo deben apretarse.
“ADO es como una campana de alarma que suena en el momento en que el oxígeno comienza a caer”, dice Matthews. “La mayoría de los sistemas del cuerpo toman tiempo; tienen que copiar ADN, producir ARN y construir nuevas proteínas. ADO se salta todo eso. En segundos activa un interruptor bioquímico.”
La hidralazina actúa uniéndose al ADO y bloqueándolo, lo que significa que efectivamente “silencia” esa alarma de oxígeno. Una vez silenciada la enzima, las proteínas de señalización que normalmente degrada —llamadas reguladores de la señalización de la proteína G (RGS)— permanecieron estables.
La acumulación de proteínas RGS, dice Shishikura, les dice a los vasos sanguíneos que dejen de contraerse, anulando efectivamente la señal “de compresión”. Esto reduce los niveles de calcio intracelular, al que llama el “regulador maestro de la tensión vascular” A medida que disminuyen los niveles de calcio, los músculos lisos de las paredes de los vasos sanguíneos se relajan, lo que provoca vasodilatación y una caída de la presión arterial.
De la preeclampsia al cáncer cerebral: un objetivo común
Antes de este estudio, los investigadores y médicos del cáncer habían comenzado a sospechar que la ADO era importante en el glioblastoma, donde los tumores a menudo tienen que sobrevivir en bolsas de muy poco oxígeno, explica Shishikura. Los niveles elevados de ADO y sus productos metabólicos se han relacionado con enfermedades más agresivas, lo que sugiere que detener esta enzima podría ser una estrategia poderosa, pero nadie tenía un buen inhibidor para probar esa idea.
Para ver si la hidralazina era un contendiente, Shishikura trabajó en estrecha colaboración con bioquímicos estructurales de la Universidad de Texas, quienes utilizaron cristalografía de rayos X, una técnica de imágenes de alta resolución, visualizar la hidralazina unida al centro metálico de ADO, y con neurocientíficos de la Universidad de Florida, quienes probaron los efectos del fármaco en células de cáncer cerebral.
Descubrieron que la vía ADO que regula la contracción vascular también ayuda a las células tumorales a sobrevivir en entornos con poco oxígeno. A diferencia de la quimioterapia, que tiene como objetivo matar todas las células por completo, la hidralazina interrumpió ese circuito de detección de oxígeno, desencadenando una “senescencia” celular o un estado latente y sin división en las células de glioblastoma, pausar eficazmente el crecimiento sin provocar más inflamación o resistencia.
Liberar el potencial de otros tratamientos que salvan vidas
Sus hallazgos resaltan cómo los tratamientos establecidos desde hace mucho tiempo pueden revelar un nuevo potencial terapéutico y podrían ayudar en el diseño de medicamentos más seguros y efectivos tanto para la salud materna como para el cáncer cerebral.
Dicen que el siguiente paso es impulsar aún más la química construyendo nuevos inhibidores de ADO que sean más específicos del tejido y mejores para cruzar o explotar los puntos débiles, la barrera hematoencefálica, por lo que golpean con fuerza el tejido tumoral y preservan al resto del cuerpo.
Matthews también está trabajando para continuar diseñando la próxima generación de soluciones médicas al revelar la mecánica de tratamientos clínicamente probados y conocidos desde hace mucho tiempo.
“Es raro que un viejo fármaco cardiovascular acabe enseñándonos algo nuevo sobre el cerebro”, dice Matthews, “pero eso es exactamente lo que esperamos encontrar más—enlaces inusuales que podrían significar nuevas soluciones”.
Megan L. Matthews es profesor asistente en el Departamento de Química en la Facultad de Artes y Ciencias de la Universidad de Pensilvania.
Kyosuke Shishikura es investigador postdoctoral en el Grupo Matthews en Penn Arts & Sciences.
Otros autores incluyen a Eric W. Barr, Zev A. Binder, Kelly Hicks y Donald M. O’Rourke de la Universidad de Pensilvania; Ren-Ming Hu y Xie Wang de la Academia China de Ciencias Snehil R; Chilkamari del Instituto de Tecnología de Georgia; Jiasong Li de la Universidad Agrícola de Nanjing; Katelyn A. Bustin y William H. Parsons del Oberlin College; J. Martin Bollinger Jr. de la Universidad Estatal de Pensilvania; Mahaa Ayub de la Universidad Thomas Jefferson; Yiming Chen y Kirill A. Martemyanov de la Universidad de Florida; Thomas P. Keeley de la Universidad de Oxford; y Zongtao Lin de la Universidad de Washington en St. Louis.
Este trabajo fue apoyado por los Institutos Nacionales de Salud (NIDA 1DP1DA051620, DA036596 y NCI R37CA285434); la Fundación Nacional de Ciencias (CHE-2204225); la Sociedad Estadounidense del Cáncer (129784-IRG-16-188-38-IRG); el Charles E. Subvención de Nueva Iniciativa de la Fundación Kaufman; el Fondo de Investigación Universitaria; la Fundación Astellas para la Investigación de Trastornos Metabólicos; y el Fondo Herbert y Diane Bischoff.
Fuente: University of Pennsylvania/ penntoday.upenn.edu