Esta investigación, publicada en Science Signaling por Priestley et al. (2025), desvela un mecanismo fundamental y previamente desconocido en la patología de la psoriasis: la existencia y función de un glicocálix de heparán sulfato (HS) en la superficie de los propios glóbulos blancos (leucocitos), y cómo su pérdida regula su entrada en la piel inflamada.
Introducción y Concepto del Glicocálix
El glicocálix es una capa rica en proteoglicanos y azúcares que recubre todas las células de los mamíferos. Tradicionalmente, la investigación se ha centrado casi exclusivamente en el glicocálix de las células endoteliales (las que recubren los vasos sanguíneos), donde actúa como una barrera que oculta las moléculas de adhesión, evitando que los leucocitos se «peguen» a los vasos en condiciones normales.
Sin embargo, este estudio cambia el enfoque hacia el glicocálix del leucocito. Los autores postulan que los glóbulos blancos también poseen este «escudo» de heparán sulfato y que su degradación es un paso necesario para que estas células puedan infiltrarse en los tejidos durante la inflamación.
Metodología de la Investigación
Para investigar este fenómeno, el equipo utilizó un modelo de ratón con inflamación similar a la psoriasis inducida por la aplicación tópica de crema Aldara (imiquimod) durante 6 días. Este modelo provoca los signos clásicos de la enfermedad: enrojecimiento, descamación y engrosamiento de la piel (hiperplasia epidérmica).
Las técnicas empleadas incluyeron:
Uso de miméticos de HS (Tet-29): Para inhibir la enzima heparanasa y observar si proteger el glicocálix reducía la inflamación.
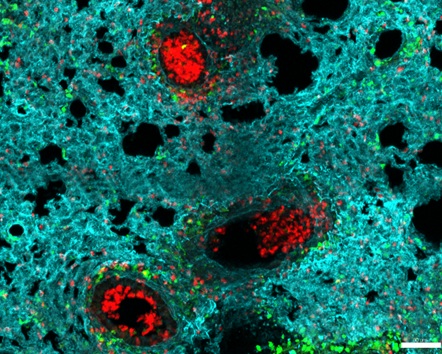
Imagen intravital: Para observar los vasos sanguíneos y el glicocálix en ratones vivos mediante microscopía de dos fotones.
Citometría de flujo e ImageStream: Para identificar qué células inmunitarias expresaban heparán sulfato y en qué cantidad.
Algoritmos UMAP: Para visualizar y agrupar las poblaciones de leucocitos basadas en su expresión de azúcares superficiales.
Resultados Principales
El Glicocálix Endotelial vs. el del Leucocito
Contrario a la creencia común, los investigadores encontraron que, en este modelo de psoriasis, el heparán sulfato de los vasos sanguíneos (endotelio) permanecía mayoritariamente intacto. En cambio, observaron una pérdida masiva de heparán sulfato en la superficie de los leucocitos de la sangre y la piel.
- Los monocitos y neutrófilos mostraron la mayor pérdida de esta capa de azúcar al activarse la inflamación.
- Se detectó un aumento de heparán sulfato «suelto» en el suero sanguíneo, lo que indica que el glicocálix está siendo cortado y vertido al torrente sanguíneo.
El Rol de la Heparanasa
La única proteína humana capaz de cortar estas cadenas de azúcar es la heparanasa. El estudio demostró que:
- La abundancia de heparanasa aumenta significativamente en la sangre y la piel tras la aplicación de Aldara.
- Las células mieloides (monocitos y macrófagos) son la fuente principal de esta enzima, liberándola para degradar su propio glicocálix y el de las células vecinas, facilitando así su movimiento.
El Experimento con Tet-29 y el Efecto Paradójico
Los investigadores administraron Tet-29, un potente inhibidor de la heparanasa, con la esperanza de detener la psoriasis al impedir que los leucocitos perdieran su escudo protector y entraran en la piel.
Los resultados fueron sorprendentes:
- Reducción de la migración: Efectivamente, Tet-29 protegió el glicocálix y redujo el número total de leucocitos (macrófagos y neutrófilos) que llegaron a la piel.
- Agravamiento de la psoriasis: A pesar de haber menos células inflamatorias, la inflamación clínica empeoró. El grosor de la piel fue mayor en los ratones tratados con Tet-29 que en el grupo de control.
La Clave: Células T Reguladoras ($T_{reg}$)
La explicación a este fenómeno reside en las células T reguladoras ($T_{reg}$), que son las encargadas de calmar el sistema inmune y reducir la inflamación mediante la liberación de IL-10.
- El estudio encontró que Tet-29 también bloqueó la entrada de estas células «buenas» a la piel.
- Al haber menos $T_{reg}$ para controlar a las células residentes de la piel que ya estaban inflamadas, la enfermedad progresó con mayor severidad.
Discusión y Conclusiones
Este trabajo redefine el modelo de reclutamiento inmunológico. Propone que la pérdida del glicocálix en el leucocito no es un subproducto, sino un requisito necesario para la migración in vivo.
Implicaciones terapéuticas:
- El uso de inhibidores de heparanasa como estrategia para la psoriasis debe ser reevaluado, ya que bloquear el reclutamiento celular puede ser un «arma de doble filo» si también se detiene a las células reguladoras.
- Se destaca la importancia de considerar la inflamación como un balance dinámico entre células pro-inflamatorias y reguladoras, donde la manipulación del glicocálix afecta a ambos grupos de manera distinta.
Los leucocitos utilizan su propio glicocálix como un regulador de «adherencia»: cuando necesitan migrar, liberan heparanasa para desnudar su superficie y poder interactuar con las paredes vasculares para entrar en el tejido dañado.
Referencia:
Megan J. Priestley,1,2 Anna K. Hains,1 Iashia Z. Mulholland,1 Sam Spijkers-Shaw,3,4 Joshua C. Müller5,6, Gareth Howell7, Amanda J. L. Ridley1, H. Davies-Strickleton1, Rebecca L. Miller8, Max Nobis6,9, Olga V. Zubkova4, Amy E. Saunders10† Douglas P. Dyer1,11†
1Manchester Cell-Matrix Centre, Lydia Becker Institute of Immunology and Inflammation, Faculty of Biology, Medicine and Health, Manchester Academic Health Science Centre, University of Manchester; Manchester, M13 9PT, UK. 2Koch Institute for Integrative Cancer Research, Massachusetts Institute of Technology; Boston, MA, 02139, USA. 3Department of Chemistry and Chemical Biology, Northeastern University; Boston, MA, 02115, USA. 4The Ferrier Research Institute, Victoria University of Wellington; Gracefield Research Centre, Lower Hutt, 5046, New Zealand. 5Laboratory for Intravital Imaging and Dynamics of Tumor Progression, VIB Center for Cancer Biology, Leuven, 3000, Belgium. 6Intravital Imaging Expertise Center, VIB Center for Cancer Biology, Leuven, 3000, Belgium. 7Flow Cytometry Technology Platform, Faculty of Biology, Medicine and Health, University of Manchester, M13 9PT. 8Copenhagen Center for Glycomics, Department of Cellular and Molecular Medicine, Faculty of Health Sciences, University of Copenhagen, Blegdamsvej 3, DK-2200 Copenhagen N, Denmark. 9Manchester Cell-Matrix Centre, Division of Cell Matrix Biology and Regenerative Medicine, School of Biological Sciences, Faculty of Biology Medicine and Health, The University of Manchester, M13 9PT Manchester, United Kingdom. 10 Division of Biomedical and Life Sciences, Faculty of Medicine and Health, Lancaster University; Lancaster, LA1 4YG, UK. 11Geoffrey Jefferson Brain Research Centre, Manchester Academic Health Science Centre, Northern Care Alliance NHS Group, University of Manchester; Manchester, M13 9PT, UK.
Fuente: Megan J. Priestley/ Douglas P. Dyer/ Lancaster University/ eprints.lancs.ac.uk